医疗设备的安全性和稳定性直接关系到患者生命健康,任何一个潜在失效都可能引发严重后果。因此,在设计、生产、使用和维护这些设备的过程中,必须具备前瞻性的风险预防能力。FMEA(失效模式与影响分析)正是应用最广泛的一种质量工具,能够系统识别潜在失效并制定对策。围绕“FMEA如何识别医疗设备潜在失效FMEA如何降低医疗设备故障风险”这一主题,本文将系统分析FMEA在医疗设备全生命周期中的实际作用,并进一步扩展其在法规合规与体系建设方面的关键价值。
一、FMEA如何识别医疗设备潜在失效
医疗设备的复杂性来源于其跨越机械、电子、软件、生物相容性等多个维度的集成特性,而FMEA恰好擅长在这种高度耦合系统中抽丝剥茧,发现可能的失效链条。
(1)设备结构层面的失效识别
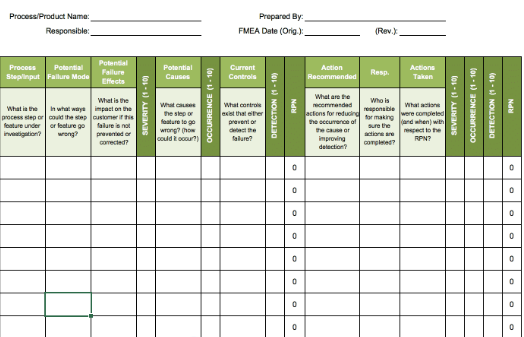
以监护仪为例,其结构模块包括显示屏、电池、电路板、外壳等。FMEA在初期识别阶段,工程团队需要针对每一个子系统制定DFMEA(设计FMEA),列出每个零部件可能的失效模式,如“显示屏亮度不均”“按钮卡滞”“传感器接触不良”等。在表格中对应记录失效原因、后果以及发生的概率,进而评估其严重度和检测能力。
(2)电气系统的FMEA识别方式
例如高频手术刀设备中的电源控制系统,可能存在“电压漂移”“保险丝断开”“温度保护模块失效”等模式,FMEA会要求工程人员提供明确的根因分析,如导体老化、电源模块选型不当等,同时提出电路冗余设计或报警机制作为预防措施。
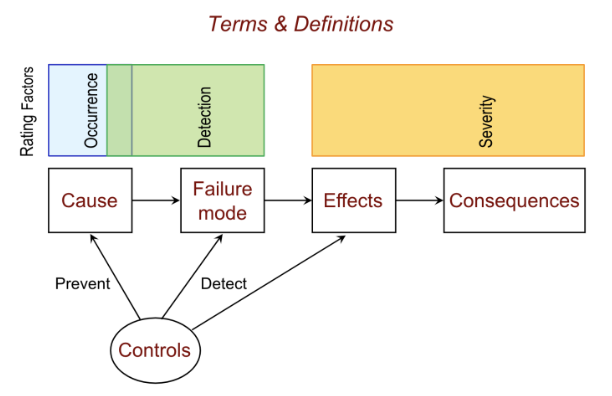
(3)软件模块的潜在失效模式识别
在嵌入式系统广泛使用的今天,软件FMEA(SW-FMEA)也变得越来越重要。以输液泵为例,系统软件中的计时器溢出、缓冲区溢出、校验算法逻辑失效,都会在FMEA表格中被列为高风险项。此时可以引入静态代码分析工具或设定实时监控机制作为缓解措施。
通过这些维度组合分析,FMEA可以构建出一套覆盖设计、原材料、系统集成与软件交互的潜在失效网络,为后续控制措施制定提供科学依据。
二、FMEA如何降低医疗设备故障风险
识别风险只是第一步,更重要的是如何通过FMEA实现有效的风险降低和控制。FMEA不仅强调找问题,更强调采取措施去“干预”潜在故障的发生。
(1)优先处理高RPN的失效模式
每个FMEA条目都伴随RPN(风险优先数)值,该数值由严重度、发生概率和可检测性三个评分项相乘得出。RPN值越高,代表该模式越危险。对高RPN项,如“灭菌器控制系统失灵”,团队需设置关键报警系统、双路供电或双传感器机制,提升系统鲁棒性。
(2)引入验证机制形成闭环
在控制措施制定后,FMEA还会指导验证流程的设计。以MRI设备为例,在识别到“冷却水泵停工”作为潜在风险后,应引入温度超限模拟测试,验证报警系统和自动停机系统是否响应及时。这种验证不仅提升了系统可靠性,也为满足医疗器械法规提供了数据支持。
(3)与CAPA机制联动实现持续更新
医疗设备在使用过程中会不断出现新的故障数据,FMEA必须动态更新。通过与CAPA(纠正与预防措施)机制协同,每次设备故障记录都应反向更新FMEA文档。例如,一款输液器反馈存在“气泡检测误报”问题,团队需调整其检测灵敏度并补充到FMEA控制项中,实现“识别-整改-验证”的闭环管理。
(4)整合全流程的质量体系
FMEA的控制措施应涵盖研发、采购、制造、装配和售后全过程。比如在制造阶段,针对“焊接点不牢”这一PFMEA项,需在作业指导书中规定焊接电流、电压范围,并通过SPC统计过程控制实现在线监控。而在售后阶段,维保人员的FMEA培训也能提升对问题识别的敏感性,防患于未然。
最终通过多层次干预手段,FMEA能实质性地降低医疗设备的故障率,为患者提供更高水平的安全保障。
三、FMEA如何支持医疗器械法规合规与注册资料编制
在法规监管日益严格的背景下,FMEA还承担着支持医疗器械合规文件编制的重要职能,尤其是在ISO 14971风险管理体系、欧盟MDR和中国NMPA医疗器械注册体系中。
(1)满足ISO 14971风险管理要求
ISO14971标准要求医疗设备生产企业建立全生命周期的风险管理流程。FMEA与此高度契合,尤其是在“危害识别、风险估算、风险控制、残余风险评估”等环节中。通过将FMEA文档作为风险文件的核心组成部分,企业可以清晰展示其风险控制逻辑,提升产品注册时的通过率。
(2)支撑技术文档与注册申报材料
在撰写医疗器械产品技术要求或注册申报材料时,FMEA输出项——如失效模式列表、严重度评估、控制措施计划、验证方案等,均可直接作为注册资料的支撑内容。特别是在欧盟MDR中,FMEA是风险管理文件(RMF)中必不可少的核心元素之一。
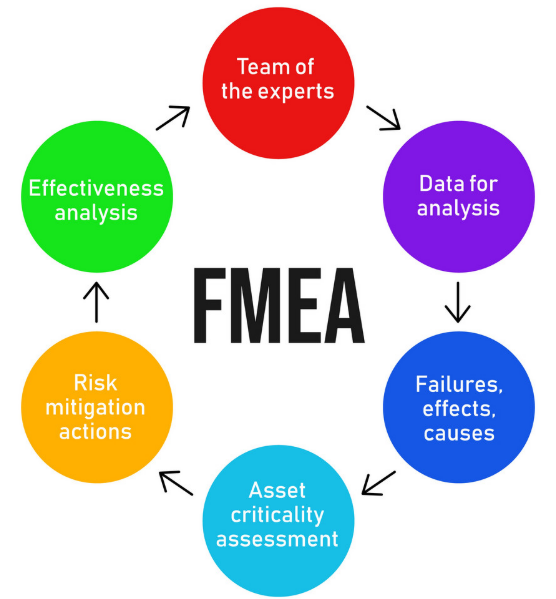
(3)协助第三方审核与客户审计
医疗设备企业在接受外部认证机构或客户审核时,是否具备完整、动态更新的FMEA体系往往是重点关注内容。审计员不仅看FMEA表格是否完整,更注重其与实际质量数据、客诉记录、变更记录的一致性。通过将FMEA嵌入QMS(质量管理系统)中,企业可有效提升其体系合规性和透明度。
(4)FMEA与软件验证体系结合
针对II类与III类高风险医疗器械,如呼吸机、心脏起搏器等,软件模块往往是审查重点。通过将软件FMEA与IEC 62304软件生命周期标准结合,企业可建立起从软件需求到故障响应的闭环系统,提升软件可靠性与法规适应能力。
在合规监管不断升级的背景下,FMEA不仅是风险技术工具,更是质量合规的桥梁,帮助企业应对审查压力、提高产品公信力。
总结
围绕“FMEA如何识别医疗设备潜在失效FMEA如何降低医疗设备故障风险”这一主题,本文从技术分析、故障控制到法规合规三个层面深入剖析了FMEA在医疗设备行业中的实际价值。FMEA不仅能够准确找出潜在风险,更关键的是能够为企业建立起一套覆盖研发、制造、使用和监管的完整风险预防体系。在医疗器械质量要求愈加严苛的时代,FMEA已不再是可选项,而是关乎企业安全底线与法规生存能力的必备核心。
